成都生物所发现新型化学小分子药物靶向TRBP-Dicer蛋白相互作用调节microRNA生物合成治疗肝癌的研究成果
作者:王飞
时间:2022-08-26
近日,中国科学院成都生物研究所王飞研究员团队在国际药物化学领域顶级期刊《Journal of Medicinal Chemistry》以封面论文形式发表题为“Discovery of a Novel Small-Molecule Inhibitor Disrupting TRBP?Dicer Interaction against Hepatocellular Carcinoma via the Modulation of microRNA Biogenesis”的研究成果。该工作通过基于表型的高通量筛选发现一个苯基噁唑类小分子CIB-3b可以通过破坏TAR RNA结合蛋白2(transactivation response RNA-binding protein 2, TRBP)和Dicer的蛋白间相互作用,从而调控细胞内微小RNA(microRNA, miRNA)的生物合成,有效的抑制肝癌细胞在体外和体内的增殖与转移。CIB-3b是国际上首个靶向TRBP-Dicer蛋白质相互作用的化学小分子抑制剂,为开发针对miRNA治疗肝癌提供了新的潜在治疗手段。

封面论文
非编码RNA占到了人体内基因组中70%以上,被认为是生命的暗物质。这些非编码RNA包含相当多的种类,其中近年来被研究最多的是微小RNA与长链非编码RNA。越来越多的证据表明,这些非编码RNA参与了几乎所有的生命过程,包括器官发育,组织修复以及免疫等活动。miRNAs是一种内源性的、长度约为22个核苷酸的非编码RNA,可与目标mRNA结合从而影响其翻译水平的表达。miRNAs表达水平失调是肿瘤的主要特征之一,这种异常会促进癌细胞的增殖、迁移和转移,维持肿瘤生长的微环境。目前若干个基于核酸的miRNA抑制剂或模拟物正在开展临床研究,但是此类药物开发存在较大的技术难度,包括脱靶效应、较差的细胞通透性及非特异性激活免疫系统等。RNA结合蛋白(RNA-binding proteins)通过与不同类型的RNA结合,形成核糖核蛋白从而参与了对RNA代谢和功能的影响。虽然RNA结合蛋白参与了诸多疾病的发生,是潜在的新型药物靶点,但是目前由于筛选技术的限制,只发现了如HuR和LIN28等少数几个RNA结合蛋白的化学小分子抑制剂。因此,进一步采用基于表型的筛选方法,获得RNA结合蛋白化学小分子抑制剂是针对非编码RNA药物开发的新途径。
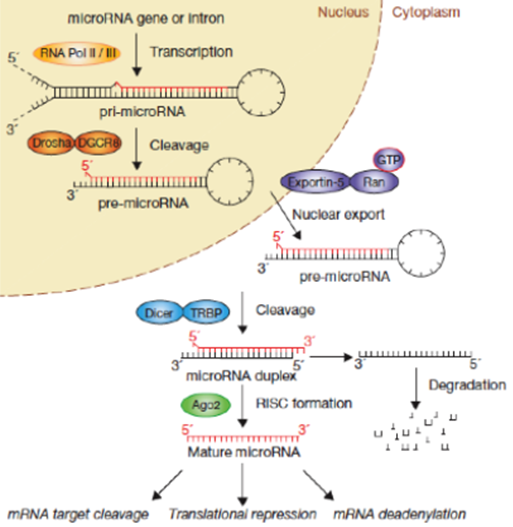
图. microRNA的生物合成途径
肝癌是全球第六大常见肿瘤,也是全球第三大癌症相关死亡原因。其中,亚洲地区受饮食习惯和文化环境的影响,相比欧美国家发病率更高。2020年,中国肝癌患者占全球新发病例总数的45%,死亡病例占全球肝癌死亡总数的47%。手术切除是肝癌发病早期的一种治疗方法,但治愈率并不理想,5年内复发率高达70%。此外,由于肝癌早期的诊断难度较大,大多数患者确诊时已经是晚期;另一方面,高耐药性和药物毒性使得肝癌的药物治疗更加困难。因此,化疗和靶向药物如索拉菲尼和乐伐替尼的疗效都不尽人意,中位总生存期仅为6-12个月。过去研究表明,miRNAs的种类和表达变化参与了肝癌发生的各个阶段,也被作为生物标志物用于癌症早期诊断、预测治疗效果和确认进展风险。因此,通过化学小分子药物调控肝癌细胞内miRNA的表达将为肝癌治疗提供新的治疗手段。TRBP过去被发现作为一种RNA结合蛋白,参与到HIV的病毒复制,调控肿瘤转移和血管生成密切相关基因mRNA的稳定性。近年来的研究表明,TRBP也是miRNA加工过程中的关键蛋白,它能提高Dicer 剪切pre-miRNA形成成熟miRNA的效率和精度,而TRBP的突变将导致miRNA的异常表达而诱发癌症的发生。2021年,王飞研究员团队同样发表在《Journal of Medicinal Chemistry》(2021, 64:7404–7421)的文章中曾报道过,从中药五味子中获得的联苯环辛烯类木脂素Gomisin M1通过靶向TRBP影响了细胞内miRNA的生物合成从而抑制肝癌细胞的增殖和转移,表明TRBP可以作为一个新的抗肿瘤药物靶点。
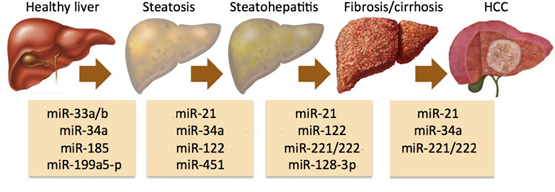
图. microRNA参与了肝癌的发生与发展
本研究工作中,王飞研究员团队通过可以检测细胞内miRNA表达的高通量筛选及先导化合物结构优化,发现一个2-苯基噁唑衍生物CIB-3b能有效的抑制miRNA的生物合成(EC50 ~ 1.38 M)。进一步研究显示,CIB-3b只影响了成熟miRNAs的表达,而对miRNAs的前体包括primary-和precursor-miRNAs的表达没有影响,并且在体外和动物体内能显著抑制肝癌细胞的增殖和转移。通过对肝癌细胞miRNA表达谱和蛋白质组的测序和分析发现,CIB-3b影响了43个miRNAs的表达,调控了Notch, TGF- ,EMT等与肿瘤增殖和转移相关的信号通路。为了进一步确定CIB-3b的直接靶点,利用免疫共沉淀、间接竞争ELISA、基因敲除等研究方法,首次揭示了该化合物通过靶向TRBP,破坏了TRBP和Dicer的相互作用,进而降低了Dicer剪切pre-miRNA的活性,从而影响了部分与肿瘤密切相关miRNAs的表达发挥其抗肿瘤作用。同时,利用核磁共振、表面等离子共振技术和等温滴定等方法揭示了CIB-3b与TRBP具有直接的物理作用,其亲和力KD ~为10 nM,远优于报道的可以与TRBP结合的化学小分子Gomisin M1(KD ~ 8.06 M)和依诺沙星(KD ~ 12.56 M)。通过合成44个CIB-3b衍生物评估构效关系,发现大部分化合物具有抑制miR-21的活性,其中有6个化合物与CIB-3b的活性相当,均表现出良好的抗肿瘤能力和靶向TRBP的亲和力。蛋白质-蛋白质相互作用在调节生物过程,细胞和信号传导途径中起着至关重要的作用,因此靶向蛋白质之间的界面在药物发现中具有巨大的潜力。然而,靶向蛋白-蛋白相互作用长期以来被认为是一项非常困难的任务,因为界面相对较大,通常是扁平的而没有特异性配体结合口袋。该研究首次发现了苯基噁唑衍生物可以通过破坏TRBP-Dicer蛋白相互作用,使细胞内与肿瘤相关的miRNAs恢复到正常生理状态,为进一步开发具有广谱抗肿瘤作用的first-in-class创新药物提供了新的药物靶点及候选小分子。

图. CIB-3b的作用示意图
中国科学院成都生物研究所天然产物结构与功能项目组王飞研究员、张国林研究员、卢晓霞研究员,成都中医药大学胡凯峰教授为本论文共同通讯作者。该研究得到了国家自然科学基金和中国科学院战略生物资源服务网络计划等项目的资助。




