成都生物所王飞团队在开发RNA结合蛋白TRBP抑制剂治疗肝癌的研究中取得新进展
时间:2025-03-28
近日,中国科学院成都生物研究所国家天然药物工程技术研究中心王飞研究员与卢晓霞研究员团队在药物化学国际顶级期刊Journal of Medicinal Chemistry上发表题为“Design, Synthesis, and Antitumor Activity Evaluation of 2‑Phenylthiazole-5-Carboxylic Acid Derivatives Targeting Transactivation Response RNA-Binding Protein 2”的最新研究成果。该研究团队设计合成了一种新型2-苯基噻唑-5-羧酸衍生物CIB-L43,该化合物通过靶向转录激活反应RNA结合蛋白2(transactivation response RNA-binding protein 2, TRBP)展现出显著的抗肝细胞癌活性,为肝癌治疗提供了新的临床前候选药物。
肝细胞癌(Hepatocellular carcinoma, HCC)是全球第六大高发癌症和第三大癌症致死原因,而临床治疗面临严峻挑战。手术切除后5年复发率高达70%,而现有靶向药物如索拉非尼和仑伐替尼的中位总生存期仅6-12个月,且存在显著的药物耐受性和毒性问题。过去研究表明,miRNAs的种类和表达变化参与了肝癌发生的各个阶段,也被作为生物标志物用于癌症早期诊断、预测治疗效果和确认进展风险。因此,通过化学小分子药物调控肝癌细胞内miRNA的表达将为肝癌治疗提供新的治疗手段。近年来的研究表明,TRBP也是miRNA加工过程中的关键蛋白,它能提高Dicer 剪切pre-miRNA形成成熟miRNA的效率和精度,而TRBP的突变将导致miRNA的异常表达而诱发癌症的发生。2022年,王飞和卢晓霞研究员团队同样发表在《Journal of Medicinal Chemistry》(2022, 65:11010-11033)的文章中曾报道过,基于表型的高通量筛选发现一个苯基噁唑类小分子CIB-3b可以通过破坏TRBP和Dicer的蛋白间相互作用,从而调控细胞内miRNA的生物合成,有效的抑制肝癌细胞在体外和体内的增殖与转移。作为国际上首个报道的TRBP抑制剂,CIB-3b成药性还存在一定的缺陷,例如体内容易被代谢等。
为了进一步提高苯基噁唑类先导化合物的成药性,通过系统的结构优化策略:1)改造五元杂环电子密度;2)引入氢键供受体基团;3)优化苯环取代基,最终设计合成了64个衍生物。其中,42个衍生物显示出优于先导化合物的miRNA生物合成抑制活性。通过构效关系研究,团队确定了2-苯基-4-甲基噻唑-5-羧酸这一关键药效团骨架,并进一步通过苯环4位疏水片段修饰和3,5位卤素取代优化,成功获得最优化合物CIB-L43。CIB-L43展现出纳摩尔级的miR-21抑制活性(EC50 = 0.66 nM),强效TRBP结合亲和力(KD = 4.78 nM)和显著破坏TRBP-Dicer相互作用(IC50 = 2.34 μM)。机制研究表明,CIB-L43通过抑制致癌miR-21的生物合成,上调抑癌PTEN和Smad7的表达,进而阻断AKT/mTOR和TGF-β/Smad信号通路,有效抑制HCC细胞的增殖和迁移。特别值得注意的是,CIB-L43展现出优异的成药性:口服生物利用度达53.9%,体内抗肿瘤效果与一线抗癌药物索拉非尼相当且毒性更低。本研究进一步证实靶向TRBP的小分子抑制剂在肝癌治疗中的临床应用潜力,为肝癌治疗提供了极具前景的first-in-class临床前候选药物
王飞研究员、卢晓霞研究员为本论文共同通讯作者;成都生物所史海龙、余佳凌、李凌宇和姬明慧博士为本文并列第一作者。该研究得到了国家自然科学基金、中国科学院战略生物资源计划、中国科学院成都生物研究所攻关团队项目等的支持。
原文链接:https://doi.org/10.1021/acs.jmedchem.4c02041
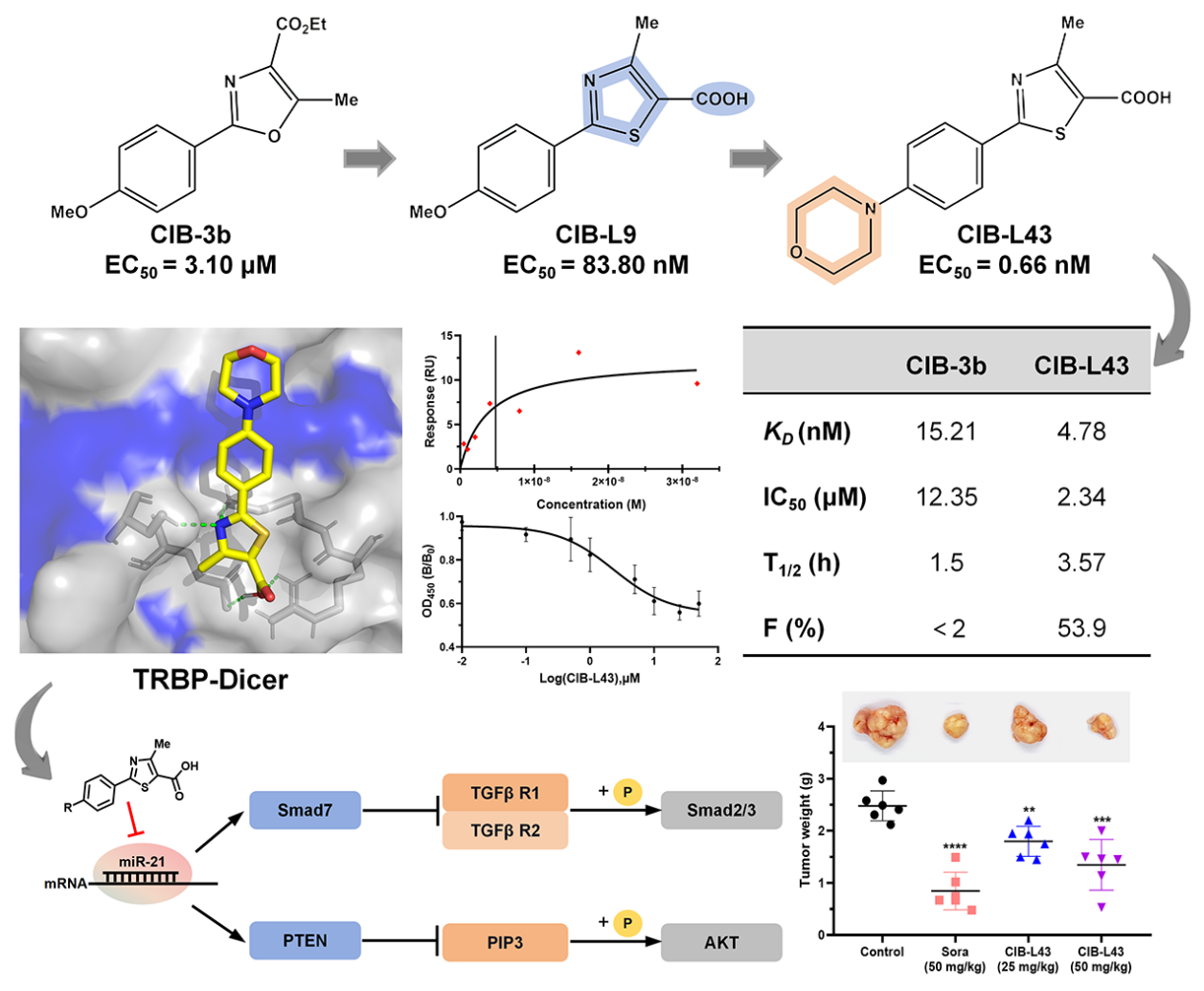
图. CIB-L43的抗肝癌作用和机制摘要图




