成都生物所在手性磷酸与镍共催化下的酰基碳苷类化合物合成研究获进展
作者:马小锋
时间:2024-03-20
酰基碳苷是一类重要的糖衍生物,因其异头羰基丰富的反应活性,以及部分含有此类骨架的天然产物表现出优异的抗氧化活性而备受化学家关注(图1A)。然而,传统的以金属试剂为核心的酰基碳苷合成方法往往步骤繁琐,条件苛刻,且产率低下。近年来,廉价金属催化或多途径协同催化的策略在酰基碳苷的合成方面已取得重要进展(图1B),但在底物范围和官能团兼容性方面仍存在一定的局限性,限制了类该类化合物的后期生物活性开发工作。
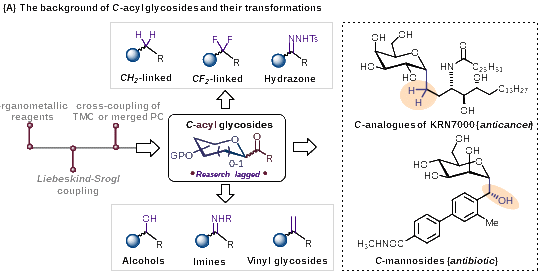
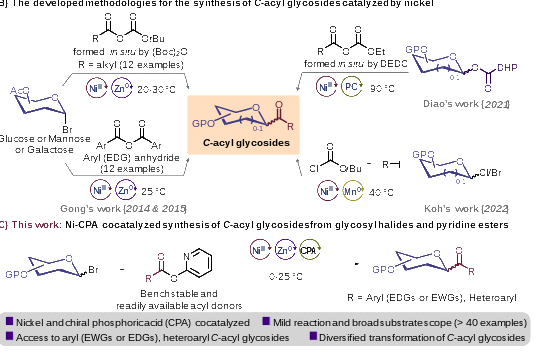
图1. 酰基碳苷的合成研究进展
中国科学院成都生物研究所马小锋课题组在前期工作中,一直致力于温和条件下多样化糖苷类化合物的合成方法学研究与生物活性方面的工作(Carbohydr. Res.2023, 108902; Chem. Asian J.2022, 17, e202200120.)。近期,该课题组成功利用镍催化剂和手性磷酸协同催化体系,在温和的反应条件下高效地完成了酰基碳苷的合成。这一新方法不仅显著提高了反应的产率和选择性,而且突破了已报道方法中对吸电子基团取代的芳基底物和杂芳基底物的限制(图1C)。
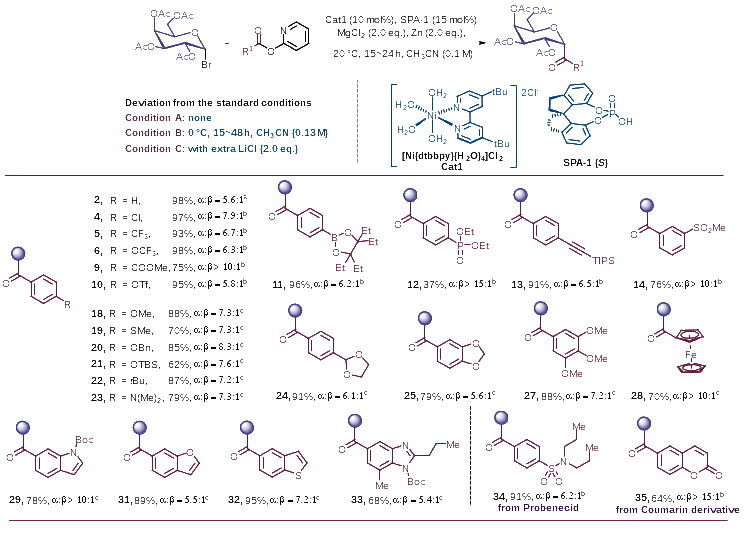
图2. 底物普适性研究
实验中的底物范围考察结果表明(图2),该方法适用于不同电子效应基团取代的芳基、杂芳基酰基碳苷的合成,各产物均具有良好的立体选择性(up to α/β >15:1)以及优异的产率(up to 99% yield)。此外,卤素、酯基、三氟甲磺酸酯、硼酸酯、炔基、醚、二甲氨基、缩醛等官能团以及二茂铁基在该反应中均具有良好的耐受性。同时,该策略还可用于丙磺舒、香豆素等活性药物分子的糖基化修饰。为进一步证明该方法的普适性,作者还对其他常见的单糖溴代物进行了底物拓展(图3)。葡萄糖、葡醛酸、甘露糖、岩藻糖、鼠李糖的酰基碳苷产物均可通过该方法顺利制备得到。
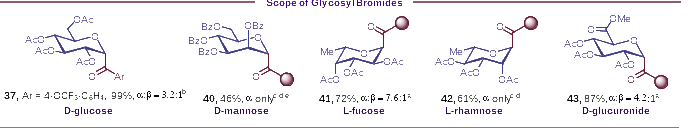
图3. 底物普适性研究
其次,克级规模放大实验进一步显示出该方法具有较高的实用价值(图4)。同时,一系列的转化实验,如将酰基碳苷中的羰基还原为亚甲基或仲醇、与炔丙基溴加成生成含炔基片段的叔醇、与盐酸羟胺成肟等,也再次印证了酰基碳苷产物多样性转化的可行性,为其他复杂碳苷类化合物的制备提供了参考依据。
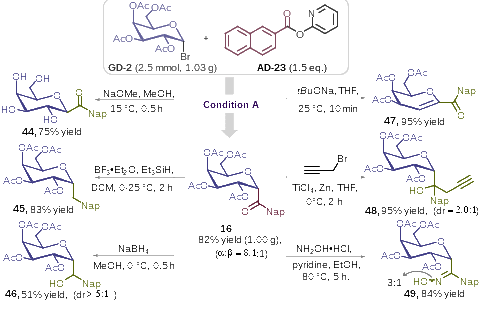
图4. 合成放大及衍生化研究
最后,初步的自由基捕获实验证明了该反应为镍催化下的自由基机制(图4a, 4b)。核磁共振磷谱监测以及紫外-可见光谱分析初步确认了该方法中的手性磷酸可能通过其双功能氢键作用活化吡啶酯和镍催化剂(图4c),进而提升反应效率。
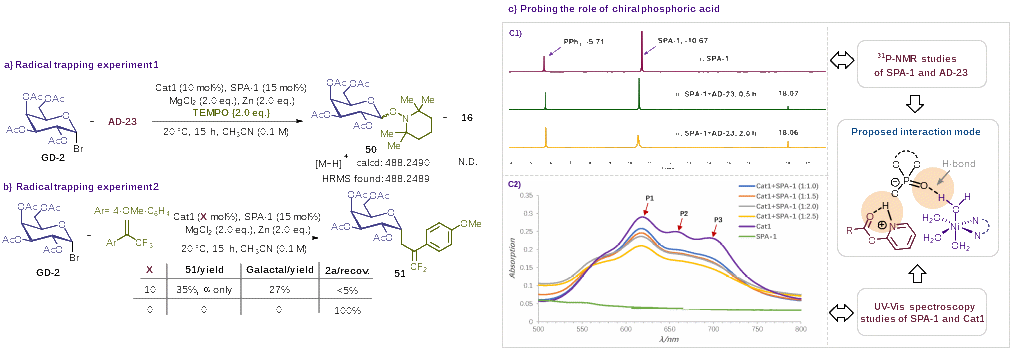
图4. 初步机理探究
该研究以“Nickel and Chiral Phosphoric Acid Cocatalysis Enables Synthesis of C-Acyl Glycosides发表于Organic Letters(Org. Lett. 2024, 26, 1332–1337)。中国科学院成都生物研究所马小锋研究员为本文的通讯作者,博士研究生张力为文章第一作者。该研究得到国家自然科学基金(22377123)、四川省科技计划项目(2022ZYD0047)、中国科学院生物资源计划(KFJBRP-008)的支持。