抑制血管增生
来源:《Science》
作者:Lee B. Rivera等
时间:2014-07-11
影响代谢(metabolism)过程可以控制血管发生(angiogenesis)。
所谓血管发生(angiogenesis)指的就是新血管生成的过程,这也是肿瘤的特征性事件之一。血管发生抑制剂(angiogenesis inhibitors)在临床抗癌治疗工作中所取得的确切治疗效果也从反面印证了血管发生过程对于肿瘤的演进所起到的重要作用。不过目前已经被批准,可以应用于临床的好几种针对血管内皮生长因子(vascular endothelial growth factor, VEGF)信号通路的抗癌药物的整体疗效都不太好,效果也并不十分显著,而且疗效维持的时间也不够长。这主要是因为肿瘤组织可以在VEGF信号通路被限制的情况下激活多条不同的信号通路,起到代偿的作用。有越来越多的证据表明,针对血管内皮细胞的代谢通路有望成为一条新的、非常有潜力的抗癌机制。这是因为血管内皮细胞的代谢活动不仅能够为血管生长提供能量,而且也能够影响血管的形成。
血管内皮细胞是贴附在血管壁内层上的一种细胞,在成年人体内,该细胞通常都处于静息状态(quiescent),但是在正常的生理进程中,或者受伤时,这些细胞也能够被迅速激活,形成新的血管杈(vascular branches)。科学家们已经在血管形成(vessel formation)方面开展了大量的研究工作,对涉及其中多个步骤的相关分子有了一定的了解,但是对血管内皮细胞的代谢进行调控会如何影响血管发生作用,现在还不清楚。在血管内皮细胞从静息期转入活动期,进行血管发生作用的时候,糖酵解作用(Glycolysis)是血管内皮细胞的一大供能途径,而且还从好几个方面直接影响了血管发生作用。不过糖酵解作用的效率要比葡萄糖氧化磷酸化代谢途径(oxidative phosphorylation)低得多。可是让我们倍感意外的是,血管内皮细胞却很少利用氧化磷酸化代谢途径,哪怕在增生、出芽,形成血管杈这种需要大量能量的时候也是如此。那么这是为什么呢?
在糖酵解过程中,葡萄糖首先会被代谢成为丙酮酸(pyruvate),这些丙酮酸然后会转变成乳酸(lactate),在这个过程中会生成两个分子的ATP;在有充足氧气供应的情况下,这些丙酮酸则会在线粒体里被彻底氧化,生成36个分子的ATP。因此,我们有理由相信,血管内皮细胞会更倾向于选择氧化代谢途径,因为在血液里有充足的氧气供应。但是考虑到新生血管的主要作用就是为原本缺氧的组织和区域提供氧气,所以氧化代谢途径也许不是一个很好的选择。因为如果血管内皮细胞依赖丙酮酸氧化代谢途径,那么就会大量消耗血液里的氧气,从而无法满足缺氧组织的血氧供应。
De Bock等人对此问题展开了研究,他们想知道糖酵解作用除了为血管生长供能之外,是否还能够对血管生长起到一定程度的调控作用。他们发现,6-磷酸果糖-2-激酶/果糖-2,6-二磷酸酶3(6-phosphofructo-2-kinase/fructose-2,6
-biphosphatase 3, PFKFB3,即PFK2)是血管内皮细胞中表达量最高的一种糖酵解酶。PFKFB3酶能够将6-磷酸果糖转化成2,6-二磷酸果糖,而2,6-二磷酸果糖则是磷酸果糖激酶-1(phosphofructokinase-1, PFK-1)的别构激活因子(allosteric activator)。因此,抑制PFKFB3酶只能够部分抑制糖酵解途径,使细胞进入静息期。这与其它完全抑制糖酵解途径的方法不一样,其它那些完全抑制糖酵解途径的手段最终会促使细胞死亡。
血管发生是一个动态的过程,需要多种内皮细胞的参与。长有很多线状伪足(filipodia)的尖端细胞(tip cell)在血管发生过程中就好像一个“开路先锋”,它们会首先迁移到新生血管将要生长到的地方,随后再由增殖能力很强的血管茎细胞(stalk cell)跟上,形成新生血管。VEGF能够激活尖端细胞,而Notch信号因子则能够起到相应的抑制作用,同时Notch信号因子还能够促进血管茎细胞的生长,详见附图。PFKFB3不仅有助于尖端细胞的形成,而且还可以抑制Notch信号因子对血管茎细胞的活化作用。有意思的是,虽然VEGF和成纤维细胞生长因子(fibroblast growth factor)这种促血管生长因子能够诱导PFKFB3因子表达,但是糖酵解过程对VEGF受体2信号通路却没有任何作用,这说明生长因子信号通路与糖酵解作用对尖端细胞的活化作用是互相独立的。至于为什么血管上皮细胞会选择糖酵解途径供能,还有一种理论认为,这是因为糖酵解酶只在尖端细胞的线状伪足里选择性表达。因此,尖端细胞在伸出线状伪足,进入缺氧地带的时候,就可以利用糖酵解途径快速获得ATP能量供应,填补它快速合成肌动蛋白丝(actin filaments)等细胞骨架结构时巨大的能量供应缺口。
Sawada等人根据上述这些发现,最近又在血管上皮细胞里发现了一种代谢调控因子,这种调控因子能够通过特异性激活Notch信号通路,同时影响血管发生信号通路的机制,抑制血管发生作用。过氧化物酶体增生物激活受体γ共活化因子1α(Peroxisome proliferator-activated receptor gamma coactivator 1–α, PGC-1α)是一种转录共活化因子,该因子参与了线粒体的生物发生过程,同时也参与了线粒体的功能。该因子在糖尿病患者和小鼠的血管内皮细胞中也有非常高的表达量。与PFKFB3因子对Notch信号通路的抑制功能不同,PGC-1α因子能够促使Notch因子活化,所以被认为具有抑制血管发生的功能,而且还能够增强血管茎细胞表型。此外,PGC-1α因子还能够抑制血管发生信号通路。所以激活PGC-1α因子也许能够抑制病理性血管增生疾病。
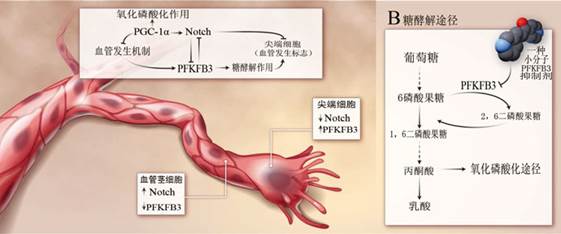
科研人员通过遗传学筛查的方式已经找到了一些具备抑制PGC-1α因子表达功能的分子,其中就包括微管抑制剂(microtubule inhibitors)和蛋白合成抑制剂。更重要的是,这些分子能够激活PGC-1α介导的氧化磷酸化途径,不过现在还没人研究过促使PGC-1α表达是否能够抑制血管发生作用。但是最近的概念验证研究提示我们,血管内皮细胞糖酵解途径是治疗血管发生相关疾病的一个非常好的作用靶点。Schoors等人使用能够抑制PFKFB3活性的小分子物质3PO(3-(3-pyridinyl)-1-(4-pyridinyl)-2-propen-1-one)进行了试验研究,他们的试验对象是银屑病(psoriasis)和结肠炎(colitis)的临床前模型(preclinical models),结果成功的抑制了血管生成。银屑病(psoriasis)和结肠炎这类炎症性疾病都会因为血管生成而加重病情。有意思的是,在黄斑变性(macular degeneration)和视网膜病变(retinopathy)这两种因为血管增殖而发病的动物模型实验中发现,针对PFKFB3也能够增强VEGF信号通路抑制剂的功效。单独使用VEGF信号通路抑制剂效果不佳可能是因为伴随的糖酵解途径还是发挥了促血管生成作用。
研究抑制PFKFB3诱导的糖酵解途径,或抑制PGC-1α的诱导表达作用,看看是否能够借此手段抑制血管发生,从而达到抗癌的治疗作用,这是一个非常值得研究的课题。抑制PFKFB3,或抑制对PGC-1α的诱导表达作用能够使脉管系统达到稳态,所以无论对上述这两条途径中的哪一条途径施加影响,都能够在血管发生机制被激活的情况下影响血管内皮细胞,使血管内皮细胞维持在静息状态。此外,基于多种原因,肿瘤细胞也和血管内皮细胞一样,倾向于选择糖酵解途径供能(此即所谓的Warburg效应),以此来适应肿瘤组织中缺氧的环境,下调线粒体的功能,关闭细胞凋亡程序。最近开展的一系列研究已经发现了多个能够阻断肿瘤细胞糖酵解途径的靶标,并且已经取得了非常不错的试验结果,但还需要开展进一步的研究,明确这些作用机制是否只限于肿瘤细胞内,亦或这些肿瘤组织的新生血管就是抗癌效果的作用途径和机制。(来源:360生物谷)
Targeting vascular sprouts
Summary Angiogenesis, the formation of new blood vessels, has long been recognized as a hallmark of cancer (1). Its functional importance for the manifestation and progression of tumors has been validated by the therapeutic effects of angiogenesis inhibitors. However, the overall effectiveness of several approved therapies that target the proangiogenic pathways controlled by vascular endothelial growth factor (VEGF) have had rather modest and transient effects in the clinic (2). This is because tumors can activate alternative pathways to adapt to vascular growth restrictions. Emerging evidence (3–5) indicates that targeting metabolic pathways in blood vessel endothelial cells may be a new and promising strategy because metabolism in these cells not only fuels vascular expansion, but also regulates the very formation of blood vessels.
原文链接:http://www.sciencemag.org/content/344/6191/1449.full.pdf




