

在过去十年当中,一类被称为蛋白激酶抑制剂的治疗药物,已经成为对抗各种危及生命的疾病(包括某些类型的白血病、肺癌、肾癌和头颈鳞状细胞癌)的强大武器。然而,这些药物的一个问题在于,它们经常抑制许多不同的靶标,这可能会导致治疗的副作用和并发症。最近,由美国圣地亚哥州立大学化学家Jeffrey Gustafson带领的一项研究,确定了一项新的技术,可提高这些药物的选择性,并可能减少不必要的副作用。
为什么蛋白激酶抑制药物如此的不可预测?答案在于它们的分子结构。
这些候选药物中,有许多药物具有一种现象,被称为旋转对映异构现象(atropisomerism)。要了解这一点,我们就要了解起作用的化学结构。分子可能以不同的形式出现,它们有完全相同的化学公式,甚至是相同的键,只是不同的排列方式。不同的排列是彼此的镜像,有一个左手和右手的排列。这种分子“旋向性”被称为手性。旋转对映异构现象,是当空间布局有一个可旋转的键(称为轴手性)时,而出现的一种手性形式。
手性的某些轴是刚性的,而其他的则可能是自由旋转的轴。在后一种情况下,意味着在任何特定的时间内,你可以有同一分子的不同的“版本”。
转折点的治疗方法
正如这个名字所暗示的,激酶抑制剂可阻断激酶(一种特殊类型的酶)的功能,并有效地关闭引发癌症的蛋白质的活性。
Gustafson解释说:“激酶抑制剂已经成为癌症治疗的一个分水岭。但是,它真的很难抑制一种单一的激酶。所确定的绝大多数化合物不只是抑制一种激酶,而是许多种激酶,这可能会导致一些副作用。”
许多激酶抑制剂具有自由旋转的手性轴。问题在于,因为你无法控制分子在给定时间内的“排列”,因此,不想要的版本可能会产生意想不到的后果。
实际上,这意味着,当药物化学家发现一种很有前途的激酶抑制剂,作为两种互换排列而存在时,它们实际上有两种不同的抑制剂。每一种都可以有相当不同的生物学效应,并且很难知道该分子的哪一个版本能靶定正确的蛋白质。
Gustafson说:“我认为,在这一领域这确实还未得以认识。该领域需要某种策略,来消除这些副作用。”
应用“制动器”
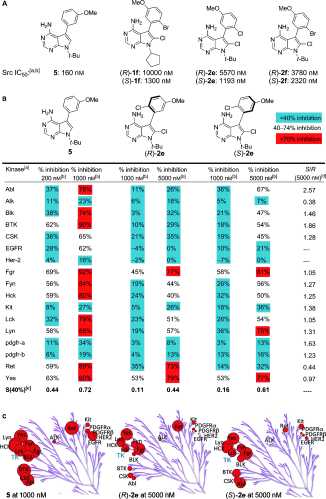
这就是Gustafson最近在化学领域顶级期刊《Angewandte Chemie》发表一项研究所做的工作。他和他的同事合成了一些阻旋异构化合物,已知可靶定酪氨酸激酶家族中一个特定的激酶。对于其中的一些化合物,研究人员添加了一个氯原子,它能有效地作为制动器,抑制阻转异构体选择,从而将分子锁定为一个右手或左手的版本。
当研究人员对他们目标激酶的修改版本和未修改进行筛选时,他们发现,不同版本的激酶有不同的抑制作用。未改性的化合物像一把猎枪,抑制了各种各样的激酶。但是锁定的右手和左手版本是更挑剔的。
Gustafson解释说:“仅仅通过将它们锁定在一个或另一个阻旋异构体结构,它们不仅更加有选择性,而且它们可抑制不同的激酶。”
他说,如果药物制造商将这项技术纳入他们的早期药物发现过程,将有助于确定哪些版本的阻旋异构化合物能靶定他们想要的目标激酶,减少副作用的可能性,并有助于引导药物克服严格的监管障碍,到达等待的患者的手中。(来源:生物通 王英)
Exploiting Atropisomerism to Increase the Target Selectivity of Kinase Inhibitors
Abstract Many biologically active molecules exist as rapidly interconverting atropisomeric mixtures. Whereas one atropisomer inhibits the desired target, the other can lead to off-target effects. Herein, we study atropisomerism as a possibility to improve the selectivities of kinase inhibitors through the synthesis of conformationally stable pyrrolopyrimidines. Each atropisomer was isolated by HPLC on a chiral stationary phase and subjected to inhibitor profiling across a panel of 18 tyrosine kinases. Notably different selectivity patterns between atropisomers were observed, as well as improved selectivity compared to a rapidly interconverting parent molecule. Computational docking studies then provided insights into the structure-based origins of these effects. This study is one of the first examples of the intentional preorganization of a promiscuous scaffold along an atropisomeric axis to increase target selectivity, and provides fundamental insights that may be applied to other atropisomeric target scaffolds.
原文链接:http://onlinelibrary.wiley.com/doi/10.1002/ange.201506085/epdf



