
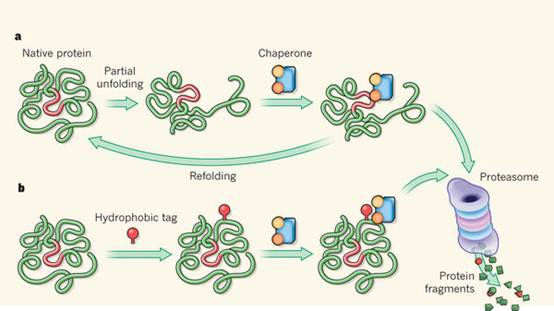
a, Cellular chaperone proteins help other proteins that have become partially unfolded to refold into their correct tertiary structure. If refolding fails, the chaperones trigger degradation of the unfolded protein by the proteasome, a large protein complex. b, Synthetic hydrophobic groups attached to a protein's surface can mimic the partially unfolded state. Because chaperones are unable to refold these proteins, the tagged proteins are degraded by the proteasome. Long et al.3 report that hydrophobic tags do not need to be covalently attached to a protein to induce degradation.
人体内大多数蛋白质很难成为小分子药物的目标。随着诱导蛋白质降解分子的发现,这个问题已经克服,这就意味着新的模块化药物开发方法。
最近研究发现,用小的合成疏水性分子共价标记的蛋白质通过细胞的质量控制机制降解。Long等人在《化学和生物学》中报道,这类分子的非共价结合也标识蛋白质的降解。这一发现可能广泛打开了药物开发方案的目标蛋白质范围。
过去十年,缺乏新批准药物反映了制药行业所面临的挑战。虽然基因组学研究进展已经确定了许多与疾病相关的蛋白质,多数这些蛋白质——尤其是那些非酶蛋白质-不是普遍可行的药物靶标。事实上,据估计只有15%的人类蛋白质组可以用小分子药化。
许多有吸引力的药物靶点,被称为“不可药化”。例如,大约有1400个人类转录因子-从DNA合成信使RNA的调节蛋白,是缺乏酶活性的。这些蛋白质在很大程度上不可药化,尽管已知它们中的一些的异常表达会导致癌症。解决这个挑战的一个可能性方法是发展小干扰RNA(siRNA),siRNA通过绑定到mRNA干扰基因表达。然而,将siRNA传递到活体内的靶标本身就是一个难于克服的障碍,而能影响不可药化蛋白质功能的小分子也有待开发。
另一个新兴的方法是破坏细胞内的靶标蛋白,而不是抑制。细胞内正常蛋白质的逆转主要是由泛素蛋白酶体系统(UPS)介导,其用泛素蛋白链为意外或错误折叠的蛋白质做上标签。一旦泛素化,被标记的蛋白质为蛋白酶所识别并被切割成肽链。高效去除多余的蛋白质是细胞生存的关键,就像蛋白酶抑制剂作为有效抗癌药剂开发所证实的效果。
已有研究报道了针对性地指定泛素蛋白酶体系统(UPS)介导蛋白质降解。其中一个方法是利用“蛋白质水解定位嵌合分子”引导有益蛋白质接近泛素连接酶(介导目标蛋白泛素化的一种酶),从而使蛋白质泛素化,随后降解。
另一个方法是使用小分子模仿蛋白错误折叠状态。通常,“脂肪”(疏水)多肽的脂肪侧链是埋在球状蛋白的内部,而亲水性氨基酸残基位于表面。即使是少量增加表面疏水性,可以使蛋白质不稳定。例如, CFTR蛋白一个氨基酸的删除,是囊性纤维化的主要原因。氨基酸“删除”令CFTR表面暴露出小块疏水点,导致蛋白质错误折叠,随后降解。
我们最近发现,蛋白表面的合成疏水基团的共价附件(如金刚烷)吸引伴侣蛋白,帮助再折叠错误折叠的蛋白质,或者,如果他们不能再折叠,标记它们被蛋白酶降解。但大多数药物通过非共价键结合蛋白质,不清楚是否非共价键结合分子也可以触发同样的程序。
Long等人解决了这一问题。他们调查了结合一个疏水基团(Boc3Arg,改良的精氨酸)的三甲氧苄二氨嘧啶(TMP)的生物效应。作者指出,在哺乳动物细胞中,TMP–Boc3Arg诱导30–80%二氢叶酸还原酶(DHFR)的降解。这取决于DHFR的合成速度。这种影响可以被TMP阻止,因为TMP与TMP–Boc3Arg竞争结合到DHFR,或被蛋白酶活性抑制剂抑制。
作者还表明,当用结合Boc3Arg的利尿酸处理时,谷胱甘肽S -转移酶(GST)被降解。结合Boc3Arg的利尿酸因共价结合到酶活性位点而成为谷胱甘肽S -转移酶的抑制剂。这说明,Boc3Arg的降解效果至少对2种酶有效。Long等人构建了一个DHFR- GST的融合蛋白,并处理细胞使其产生包含TMP–Boc3Arg或者 EA–Boc3Arg的蛋白质。他们观察到EA–Boc3Arg能更高效地降解DHFR- GST,因为EA–Boc3Arg以共价键结合蛋白质,而TMP–Boc3Arg是非共价键结合。结果暗示,酶的疏水标签共价结合物是更有效的蛋白质降解策略。
因为TMP是一个高亲和力的大肠杆菌DHFR抑制剂,需要进一步研究,以确定兼具蛋白抑制剂和退化信号的小分子是否比简单的蛋白抑制剂更有效地废除蛋白功能。正如作者所指出的,肉毒杆菌毒素降解方法就是一个有力的例证。这种毒素最有力的形式是导致肌肉麻痹,在体内的半衰期约3个月。尽管毒素抑制剂可以短期抑制毒性,但消除毒素显然是最好的治疗方法。
然而,boc3arg基团非常大(约500道尔顿),大分子往往有较差的药代动力学特性,限制其作为药物的用途。所以,结合其到现有的抑制剂可能降低抑制剂的药代动力学特性。奇怪的是,尽管TMP对大肠杆菌DHFR有高亲和力,并被认为具有良好的细胞通透性,Long等人却需要使用高浓度的TMP–Boc3Arg才能观察蛋白质的降解。这表明,TMP–Boc3Arg难以渗透细胞。
其他非共价配体–蛋白系统需要进行测试,建立最低限度的配体-蛋白的亲和力,这是启动蛋白质降解所必要的。同时,猜想这一蛋白降解策略模块化如何用于药物开发也是有趣的事情。人们可以设想一个精简的过程:不可药化蛋白的配体被确定,粘贴上疏水基团(如金刚烷或Boc3Arg),测试其降解目标蛋白的能力。发现不可药化蛋白的高亲和力配体无疑是一个挑战,但越来越多的方法可用于促进其实现。
例如,化学图书馆,其中每个化合物连接到一个独特的DNA“条形码”,可以用于检测蛋白结合力,而拥有最高亲和力的化学实体随后使用“条形码”确定。这种方法将允许109个以上的化合物的快速筛选,然而目前使用试剂盒的最大的筛选力只有106个化合物。这种高通量筛选方法与疏水标记方法的结合,可以使现今的不可药化蛋白在探求减轻人类疾病的化合物时成为有吸引力的生物目标。(编译:中国科学院成都生物研究所王芋华,王海燕)
Inhibitor Mediated Protein Degradation
Abstract The discovery of drugs that cause the degradation of their target proteins has been largely serendipitous. Here we report that the tert-butyl carbamate-protected arginine (Boc(3)Arg) moiety provides a general strategy for the design of degradation-inducing inhibitors. The covalent inactivators ethacrynic acid and thiobenzofurazan cause the specific degradation of glutathione-S-transferase when linked to Boc(3)Arg. Similarly, the degradation of dihydrofolate reductase is induced when cells are treated with the noncovalent inhibitor trimethoprim linked to Boc(3)Arg. Degradation is rapid and robust, with 30%-80% of these abundant target proteins consumed within 1.3-5 hr. The proteasome is required for Boc(3)Arg-mediated degradation, but ATP is not necessary and the ubiquitin pathways do not appear to be involved. These results suggest that the Boc(3)Arg moiety may provide a general strategy to construct inhibitors that induce targeted protein degradation.
原文链接:http://www.sciencedirect.com/science/journal/10745521/19/5



